為T細胞配上導航系統-CAR-T
細胞發展趨勢與臺灣機會
DCB產業資訊組
王意婷
2022年1月
前言
1992年免疫學家使用新發展之逆轉錄病毒載體將基因引入T細胞中,用以製造強大的癌症攻擊器,隔年(1993年),以色列免疫學家Zelig Eshhar用一個嵌合分子對T細胞進行改造,被改造的T細胞即被稱為第一代嵌合抗原受體-T細胞(Chimeric Antigen Receptor T cell, CAR-T細胞)。這種CAR-T細胞雖然在技術上具有創新性,並不能在體內長久存在,亦無臨床效果,但也因此陸續展開CAR-T細胞的開發工作,直至2017年美國FDA核准2個產品,宣告CAR-T細胞治療世代來臨,同時細胞治療產業因此更蓬勃發展。
CAR-T細胞療法為腫瘤治療領域最火熱的研發項目之一
CAR-T細胞的CAR結構(圖1)包含具腫瘤抗原辨識的單鏈抗體(scFv)片段區、固定CAR於T細胞上的跨膜結構區、刺激活化T細胞增殖信號通路的T細胞活化區及維持T細胞生存時間的共刺激區。其中scFv協助T細胞靶向腫瘤,而當CAR-T細胞與腫瘤結合之後CD3 Zeta毒殺區啟動細胞毒殺作用,而活化區則增強腫瘤細胞毒殺效果。因此,CAR-T細胞療法又被稱作活的標靶藥物,成為癌症治療之抗體藥物及小分子藥物外,另一種腫瘤治療新手段。
CAR-T細胞治療在2014年被美國食品暨藥物管理局(Food and Drug Administration, FDA)指定為突破性療法後,目前已有2款CAR-T細胞治療產品上市,其分別為Novartis的Kymriah與Gilead Sciences的Yescarta,兩者皆為血液腫瘤治療用。早期CAR-T細胞療法的研究著重在如何持續產生穩定且T細胞可以被活化的CAR-T細胞治療產品;隨著技術不斷進化,近年朝具控制腫瘤微環境能力的CAR-T細胞治療產品發展,除治療血液腫瘤或其他循環系統如骨髓瘤等外,實體腫瘤治療也是各家廠商想要攻占的領域。
透過ClinicalTrials.gov統計及分析全球CAR-T細胞療法相關臨床試驗案,截至2021年1月15日,登錄的案件數超過1,150件,Novartis、Gilead Sciences、Cellectics及Fate Therapeutics等大藥廠及生技公司分別在此領域佔有舉足輕重的角色,雖目前發展的適應症仍為血液相關癌症為主,包含白血病、淋巴瘤、骨髓瘤等,但近期如胰腺癌、肝癌、腸炎、胃癌、卵巢癌及神經上皮瘤等之實體瘤治療之相關研究有逐漸增加的趨勢。
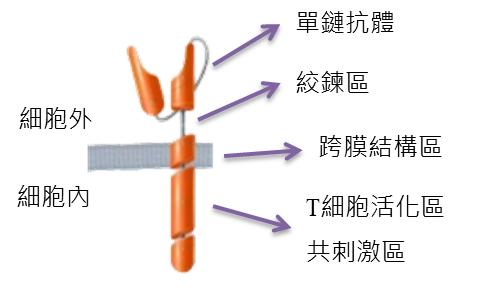
資料來源:Juno Therapeutics;DCB產業資訊組整理(2021.01)
圖1、CAR結構
實體腫瘤標的及異體CAR-T細胞為CAR-T細胞治療發展趨勢
相較於CAR-T細胞對於血液腫瘤的治療效益,面對大宗之實體腫瘤治療需求,仍有待突破之處;再者,面對產業成本競爭及提高患者使用率,異體CAR-T細胞療法因可降低生產成本並可以供應患者即時使用,因此開發新實體腫瘤標的及異體CAR-T細胞成為產業大力投入發展的方向。
1. 新實體腫瘤標的
罹患同一種腫瘤的患者,在一個部位的腫瘤不一定表達相同的腫瘤相關性抗原,因此沒有一種抗原可涵蓋全部的腫瘤細胞,高度的異質性增加實體腫瘤治療難度,標靶選擇面臨挑戰;除此之外,CAR-T細胞所針對的特定標的不僅出現在腫瘤細胞表面,亦可能出現在正常細胞表面上,若出現於正常細胞表面上則會增加嚴重副作用(細胞因子釋放綜合症)的發生率。
為能使CAR-T細胞療法應用更為廣泛,進而有效治療實體腫瘤,Novartis、Amgen、Juno等公司已針對BCMA、EGFR、CD20、MUC1、GCC、GPC3及MESO等標的進行開發,希望能在其他腫瘤如多發性骨髓瘤與肝細胞癌、大腸癌、卵巢癌及膀胱癌等實體腫瘤治療上有所突破。另,除單一腫瘤標的外,於CAR上裝載雙標的或多標的也是廠商躍躍欲試的發展方向,透過發展多標的抗體,以同時針對多個與腫瘤相關的抗原標的,提高實體腫瘤治療效果,避免在標的不明確下對正常細胞產生不良影響,目前已有Innovative Cellular Therapeutics及Fate與Janssen的合作案正在進行中。
2. 異體CAR-T細胞
自體CAR-T細胞療法相較於異體CAR-T細胞療法因不會產生免疫排斥反應,相對安全,但自體CAR-T細胞療法為對每一個病患量身製造,在目前CAR-T細胞產品製程仍相對繁瑣且高製造成本下,若患者無保險支持或無法等待數周的製造流程,將失去治療機會。
異體CAR-T細胞產品的製作為透過健康捐贈者提供T細胞製成,患者經過人類白血球抗原(Human Leukocyte Antigen, HLA)配對後,可接受來自捐贈者提供之T細胞製成之異體CAR-T細胞治療產品進行治療,或將健康捐贈者提供之T細胞剔除HLA-A/ B/ C後,再將CAR嵌入此T細胞中,製成產品以提供患者治療。異體CAR-T細胞產品提供即時可用的便利性、產品品質一致性及規模化製造而降低生產費用等優勢,使其增加在醫療上具重要性及價值,並成為具商業規模的腫瘤細胞療法。目前異體CAR-T細胞產品臨床試驗進展最快為臨床II期試驗階段,包含CRISPER、Poseida Therapeutics等公司皆已進展至此階段,另2018年美國新成立公司Allogene Therapeutics更籌措3億美元資金以進行異體CAR-T細胞產品開發工作,顯示異體CAR-T細胞產品存在發展潛力。而除了以健康成年人之T細胞製作CAR-T細胞產品,Fate公司更進一步利用多功能誘導幹細胞(induced Pluripotent Stem Cells, iPSC)製作異體CAR-T細胞產品,因iPSC在體外更容易進行基因工程修飾,期望能設計出更不會造成免疫反應,且具生產效能的產品。
臺灣可直接朝向新實體腫瘤標的或低免疫原之異體CAR-T細胞發展
臺灣細胞治療產業尚無CAR-T細胞治療產品問市,且進入臨床試驗階段的CAR-T細胞治療產品僅1件,宇越生技治療淋巴瘤之自體CAR-T細胞治療產品,目前於臨床I期試驗階段。此外,在CAR-T細胞治療產品開發,目前有源一、台成幹細胞、育世博、台灣尖端、震泰、沛爾、先驅及承寶等廠商著手進行CAR-T細胞治療產品設計及開發工作。
臺灣如要在國際腫瘤免疫細胞治療產業中佔有一席之地,建議可直接擇定尚未突破之實體腫瘤為發展標的,尋找具特定腫瘤專一性之生物標記加以開發,結合多共同刺激訊號或細胞激素的新一代CAR-T細胞,或於CAR上結合多種標的的抗體藥物及特定蛋白以增加CAR-T細胞治療效果;或發展剔除HLA剔除之異體CAR-T細胞治療產品,採用現貨(Off-the-Shelf)方式供應,將其當作一般生物藥品一樣的方式發展,應可解決個體免疫排斥反應及高費用等問題。
新實體腫瘤標的或低免疫原之異體CAR-T細胞治療產品,全球目前仍處於發展階段,現階段臺灣投入正是時候。隨著臺灣細胞治療研發不斷創新與精進與法規的逐步開放,臺灣CAR-T細胞治療廠商及學研單位持續投入資源,創造創新技術平台,使CAR-T細胞治療能朝向新腫瘤標的及高生產效能之異體產品邁進,後續進展值得持續關注。



