活動日期:110年06月25日
指導單位:經濟部工業局
主辦單位:生醫商品化中心藥品領域
協辦單位:財團法人生物技術開發中心
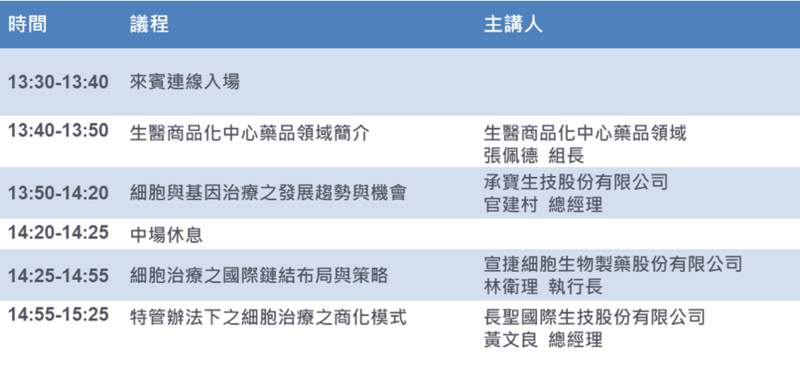
近年來新興生物療法,如細胞療法、基因療法及核酸藥物等發展逐漸引人注目。目前細胞及基因治療已有多種產品上市,全球市場蓬勃發展;然而在進入商業化階段,各廠商仍面臨許多挑戰,包括公司商業模式、各項資源引入、國際鏈結與發展布局,以及在法規制度下,如何創造細胞及基因療法的創新商業模式等。
為了進一步探討新興生物療法的發展趨勢與細胞及基因療法的商業化策略,生技中心和生醫商品化中心在6月25日舉辦一場「新興生物療法發展趨勢及契機PART I-細胞及基因療法之商業化策略」線上研討會。
邀請國內重量級細胞及基因治療產業代表,分享新興生物療法公司的商業模式及資源導入策略、臺灣細胞治療廠商的國際鏈結布局,以及在特管辦法公告後,細胞治療產品的商業化模式及面臨的挑戰。期望透過重量級廠商的分享,加速細胞及基因治療產業的發展、促進產業升級。
2025全球再生醫療產值將達到1240億美元
生技投資熱潮已由免疫療法轉向再生醫學,估計2025年全球再生醫療產值將達到1240億美元;而根據Businesswire統計,全球細胞及基因治療產業從2023年到2030年,市場年複合成長率將達到24.1%;引發國際藥廠爭相卡位,大藥廠急於以併購方式跨入再生醫療領域,發展再生醫療相關技術的生醫新創也受到投資界的青睞。
根據統計,2019年,全球在再生醫療領域的併購案金額達到112.8億美元,其中最受矚目的併購案,包括:羅氏藥廠以48億美元的金額併購Spark Therapeutics、Catalent以12億美元收購Paragon Bioservices股權、Biogen以8.77億美元收購Nightstar Therapeutics等,都掀起全球藥界的漣漪。
賽默飛亦在2019年,以17億美元收購Brammer Bio;2021年再以8.73億美元,併購法商Novasep位於比利時的病毒載體製造廠,可見得賽默飛看好再生醫療領域的前景。
在台灣,旅美生技專家楊育民攜手國際大咖,成立韌力生技,聚焦在CDMO,首輪募資即達到8億美元(約新台幣224億元),改寫台灣生技製藥史的新高紀錄。
由於疾病治療在這段時間以來,出現許多創新的醫療技術,從小分子化學藥物、植物藥、蛋白質藥物、抗體藥物,一直到現在熱門的細胞與基因治療、再生醫療藥物,雖然技術的門檻越來越高、系統越來越複雜,但能夠解決的問題和疾病也更多,以前被視為絕症或無藥可治的疾病都出現治癒的曙光。
2025 每年將有10至20個產品取得上市許可
根據美國再生醫學聯盟的報告,在2020前三季的統計,再生醫學領域募資金額達到159億美元,比起去年同期成長115%,進入人體臨床試驗的數量也逐年增加,其中包含基因治療、基因修飾型的細胞療法以及純粹的細胞療法,以及基因工程的再造等。
前美國FDA局長、藥審專家Peter Marks預測,2020年,每年有超過200件細胞與基因治療產品申請IND(試驗中新藥),估計2025年,每年將有10~20個細胞與基因療相關產品取得上市許可。
承寶生技總經理官建村表示,細胞與基因治療改變了人類治療遺傳疾病和疑難雜症的方式,並逐漸翻轉整個製藥的生態圈。根據美國再生醫學聯盟(ARM,Alliance for Regenerative Medicine)的報告,2017年~2019年,共有超過1,000項臨床試驗正在展開或正在進行中。
基因療法是透過修改患者的特定基因突變,以達到疾病治療效果的新興療法,時下所提到的基因療法也涵蓋多種細胞療法,例如CAR-T、CAR-NK、TCR-T等,都是透過基因編輯技術來改造免疫細胞,再輸送到患者的體內,修復病變異的細胞、基因和組織。
截至目前為止,美國FDA已經通過22種細胞及基因治療的產品,其中就包含5種CAT-T產品。由於這非常新穎的醫療與生物技術,因此受到法規嚴格的管制,到今年四月為止,目前全球正在臨床試驗階段的細胞與基因治療產品共有2043個,比起去年增加38%,(其中CAR-T增加299項,比去年增加35%;TCR-T增加80項;CAR-NK增加67項),顯示這三種免疫細胞是目前全球最主要的細胞與基因治療產品標的。
合併治療是人類終結疾病的最終手段
值得關注的是,發展細胞與基因治療產業仍有許多瓶頸需要突破,包括:產品是否能滿足實際的醫療需求、產品的安全性、法規鬆綁、市場的接受度、技術產生的風險、國際資金的持續挹注、產業生態鏈的形成…等,都是細胞與基因治療產業得以蓬勃發展的關鍵指標。將細胞與基因治療運用在治療實體腫瘤、神經退化性疾病、慢性病和老化疾病等,則是極具潛力的領域和發展方向,而合併治療應該是人類終結這些疾病的最終手段。
Chimeric Antigen Receptor (CAR)-T 細胞是帶著衛星導航(GPS)最有效的標靶性免疫細胞,是留在體內的活藥(Living Drug)!,全球第一個接受CAR-T免疫細胞療法的是一位6歲的女孩Emily,在經過CAR-T細胞療法後,至今已經完全康復。
這個成功的案例開啟無數年輕白血病患者治癒的曙光,也帶動產業發展的新商機。目前全球已經有五個CAR-T相關產品上市,分別是由Novartis、Kite/Gilead、BMS/Celgene/ Juno、BMS/Bluebird,這幾家公司所開發的。
不過治療費用昂貴則是CAR-T免疫細胞療法最讓患者和家屬望之卻步的痛點,從一個療程37.3萬美元到47.5萬美元不等,對於一般患者來說,是一道難以跨越的高牆,這也是目前許多廠商急於克服的難關。
跨國藥廠佈局牽動全球醫藥技術發展
宣捷細胞生物製藥執行長林衛理指出,現在所謂的細胞與基因治療公司已經進展到第三代,所謂第三代的公司是已經掌握了全球最夯的細胞與基因治療科技,透過AI人工智慧的分析,在安全性方面可以預測幹細胞的致癌性、在功能性方面,可以評估幹細胞分化成神經幹細胞、胰臟、胰島素的趨勢,大幅縮短藥物研發的時程與提高成功率。
不可諱言地,目前跨國藥廠的全球佈局策略仍深刻影響整體醫療技術的發展,甚至主導的產品研發與技術授權的方向,而近來最明顯的趨勢就是這些跨國藥廠挾著龐大的資源,在全球積極併購具有潛力或獨特創新技術的生技公司,企圖利用併購方式,擴大有效的專利地圖、縮短學習和獲利的曲線。
「以中小企為主的臺灣生技產業,應對跨國藥廠的全球布局有深刻的了解,才能在這一波細胞與基因治療的浪頭上佔有一席之地,擠身全球產業鏈的參與者。」林衛理指出。
他表示,跨國藥廠選擇合作公司的考量重點包括:顛覆性創新技術/產品、完整專利組合、獨一無二的技術平台、與眾不同創新產品、與大藥廠核心營運領域相關、與大藥廠主要產品具加乘效益、併購創造高附加價值、具專業與高效率的經營團隊,以及低成本高產出的新藥研發能量。
顛覆性產品與完整專利組合 吸引國際藥廠青睞
以下舉幾個例子,例如有一家從哈佛大學衍生公司-Semma,Semma由人類的成人體細胞誘導為多能幹細胞,再利用其專利技術生產出胰臟島細胞,這些島細胞可以根據血液中的葡萄糖含量來精準調控胰島素的分泌,使血糖維持在穩定的狀態,當初在被併購時,他已經有一個GMP等級的量產工廠,可以生產這些細胞產品,且研發進程已到靈長類動物試驗,因此在2019年被Vertex相中,以9.5億美元的金額收購,看中的就是Semma具有顛覆性創新的藥品。
Semma這家公司從創立開始就是得天獨厚,在2015年的A輪募資中就募集了4400萬美元,2017年的B輪募資更直接籌集 1.14 億美元,創立四年之內創造22倍的市值。雖然Semma先天就具備優勢,但該公司的產品研發的速度和產品的創新性都讓人眼睛一亮,將顛覆性創新的技術運用在獨特的疾病治療上,這正是Vertex看重的關鍵報告。
另一個代表性公司是BlueRock,這家公司利用AI人工智慧分析醫療大數據,找出最健康的捐贈者體細胞,透過從日本授權的iPSC(誘導性多能幹細胞)的技術,在利用基因編輯技術,將所有可能造成疾病或免疫排斥的基因都剔除,複製成多個細胞株;
然後利用AI人工智慧分析,預測該細胞株是否安全、具有致癌性風險,在功能性方面,預測是否可以引導分化為神經幹細胞、胰臟島細胞、肌肉細胞,再利用這些具有功能性的細胞達到疾病治療的目的,基本上就是可用於異體治療,同樣的細胞可以給很多人使用、治療疾病。
顛覆性產品吸引大藥廠早期投入巨資或併購
拜耳為了建立細胞治療領域的領先地位,因此積極在全球蒐集值得併購的對象,2016 年,拜耳與BlueRock創始投資人-Versant Ventures,共同參與A 輪募資以 2.25 億美元成立BlueRock,之後,2019年8月,拜耳再以6億美元收購其餘的股份,完全掌握BlueRock的技術與主導權。
當初拜耳投資BlueRock的費用是希望這家公司去搜尋、授權取得全世界最新、最具潛力的技術,例如基因編輯、iPSC等技術,然後推向一期臨床試驗階段,後來發現細胞與基因治療這個領域的進展突飛猛進,拜耳希望加速該領域的研發進展,因此直接將BlueRock完全收購。
BlueRock從創立到被拜耳收購,短短三年的時間,產品進展才完成臨床前試驗,剛要邁向臨床一期,公司就創造了4.5倍的價值,達到10億美元的市值。由此可見,只要生技公司具有獨一無二的顛覆性產品、精準運用在某項疾病領域,大藥廠是很願意在早期階段就投入巨額資金,協助公司繼續發展。
緊接著,林衛理談談,為何大藥廠為何十分在意完整的專利組合、知識產權的保護。所有的創新研發技術都要有完整的專利組合,不是零星的幾個專利就好。
「完整的專利保護,才能讓有價值的知識產權發揮最大的效益。」林衛理表示。
基本上,專利也是一種被動防禦,保護自己的知識產權不會被侵犯,更積極主動的智財保護則是充分利用這些權利去創造營收,無論是技術授權、技術合作、合作開發,換取自身研發量能不足的地方,當然藉由專利訴訟取得鉅額賠償金也是大藥廠慣用的手段。
沒有完整專利保護 無法走向國際市場
對於大藥廠來說,專利佈局反應新創企業的競爭優勢和地位,不僅可以保護免受其他廠商的侵害,還可以利用這項武器在法庭上捍衛本身使用、製造、銷售或授權的唯一權利,未經許可,禁止其他廠商使用、製造、銷售或授權,還可以增加策略聯盟的機會,不管是被動防禦還是主動出擊,都是非常重要終極利器。
因此,準備或即將投入細胞與基因治療領域的公司,一定要非常注意避免踩到國際藥廠或其他生技公司的專利地雷,同時在產品研發初期就要有完整的專利布局思維,不能僅是走一步算一步,畢竟一項創新的產品都會牽涉到許多機制和技術,沒有完整的專利保護很難走向國際市場,也無法吸引跨國藥廠的青睞。
在專利佈局方面,長聖生技總經理黃文良有幾個建議,包含:配合免疫細胞治療以及幹細胞治療,雙技術平台的完整佈局、考量與外國大廠進行合作授權,切入技術領先的美國市場、新藥研發著重國際佈局,市場應首重歐、美、日、台、為妥善利用特管辦法領先的優勢,須強化營業秘密的保護、持續發展下一代CAR-T技術,地毯式建構專利能量、同時也要善用專利制度,在第一時間保護專利的有效性。
他以長聖生技為例,長聖涵蓋樹突細胞疫苗及幹細胞相關專利共計56件,已取得專利 28件、申請中專利28件,其中核准獲證的國家包含:臺灣、美國、歐盟、日本等國家;而瑞典、丹麥、德國、比利時、法國、英國、西班牙、義大利等國家的專利正進行中。
每一項都是門檻和挑戰 沒有任何僥倖
黃文良指出,細胞與基因治療的產品在美國已經有22種上市,其中有5種CAR-T產品、幹細胞產品則以血液疾病的幹細胞治療為主;歐盟則已有9種細胞與基因治療的產品上市,日本也有9項產品上市,主要是以iPSC、成體幹細胞和CAR-T產品為主。
值得注意的是,既然是醫療產品,就必須建立標轉作業流程(SOP)、採用最高規格的品質管理標準,有就是依據FDA/EMA/TFDA guidance、USP/EP/中華藥典、EC ATMP GMP等規範、建立關鍵品質屬性(Critical Quality Attributes, CQA)、製程步驟標準化(包含:培養參數、試劑濃度、原料品牌、儀器參數設定…)以及品質管控機制(製程中管控、放行檢驗)等,每一個步驟都不能馬虎。
再生醫療產品在商業化過程,必須包含幾個階段:基礎研究、臨床試驗、申請許可上市、生產製造以及上市與監測。每一個步驟都要走的很紮實、沒有捷徑,尤其是像細胞與基因治療這類新興生物技術產品。
從建立安全性標準GCP、建立符合再生醫療的試驗模型、統計學的評估方法與指引規則、品質檢測方法與技術、細胞製備符合PIC/S GMP規範、法規國際協和、開發關鍵細胞製程技術、推動高規格CMO、管理與布局智慧財產、上市後監測制度、治療普及化挑戰以及社會接受度等。
「每一項都是門檻和挑戰,沒有任何僥倖。」黃文良語重心長地表示。
近300人在線上共同參與
「新興生物療法發展趨勢及契機PART I~細胞及基因療法之商業化策略」線上研討會,共吸引近300人一同在線上共同參與,也引起諸多迴響,顯示細胞與基因治療確實是目前最夯的研發方向,參與的來賓和聽眾大都意猶未盡,希望往後舉被類似的活動能開放更多名額,讓有興趣的民眾或專家學者能夠共同參與。
最後,主辦單位生醫商品化中心張佩德組長不忘提醒,對於有意投入生技產業或細胞與基因治療產業的廠商、團隊或學研界人士,生醫商品化中心都能夠提供客製化、商品化的輔導服務,協助新創團隊跨越產品開發初期的死亡之谷,歡迎產學研醫各界人士與生醫商品化中心聯繫。



